อะตอมมีศูนย์กลางซึ่งเรียกว่า นิวเคลียส ซึ่งมีขนาดเล็ก มีประจุบวกเรียกว่าโปรตอนอยู่ และมีประจุลบที่เรียกว่าอิเล็กตรอนวิ่งอยู่ภายนอกแบบจำลองอะตอม นีลส์ โบร์ อะตอมเคลื่อนที่รอบนิวเคลียสเป็นวงกลมโดยแต่ละวงจะมีระดับพลังงานแตกต่างกันไป

โครงสร้างอะตอมอะตอม มีลักษณะเป็นทรงกลมแบบกลุ่มหมอก ประกอบด้วยอนุภาคมูลฐานที่มีมวลน้อยมาก 3 ชนิดได้แก่ นิวตรอน (Neutron) โปรตอน (Proton) และอิเล็กตรอน (Electron)มีนิวเคลียสอยู่ตรงกลางซึ่งภายในประกอบด้วยอนุภาคของนิวตรอนและโปรตอนอยู่ อาจเรียกว่านิวคลิออน (Nucleon) มีอิเล็กตรอนเคลื่อนที่ไปรอบๆนิวเคลียส ซึ่งไม่สามารถกำหนดความเร็ว ทิศทางและตำแหน่งที่แน่นอนได้ จึงทำให้โอกาส ที่จะพบอิเล็กตรอนในบริเวณหนึ่งๆไม่สม่ำเสมอ บริเวณที่สามารถพบอิเล็กตรอนได้ถูกเรียกว่า ออร์บิทัล (Orbital)บริเวณที่ใกล้นิวเคลียสมากที่สุดจะมีกลุ่มหมอกอิเล็กตรอนที่หนาแน่นที่สุด ระดับพลังงานของอิเล็กตรอนถูกกำหนดให้แทนด้วย n = 1 และเมื่อห่างจากนิวเคลียสมากขึ้น ความหนาแน่นของกลุ่มหมอกอิเล็กตรอนจะน้อยลง ค่าของระดับพลังงานของอิเล็กตรอนจะถูกกำหนดให้แทนด้วย n = 2 n = 3 n = 4 ตามลำดับ
 รูปโครงสร้างอะตอม
รูปโครงสร้างอะตอมการจัดเรียงอิเล็กตรอนการจัดแบ่งอิเล็กตรอนที่โคจรในอะตอมจะแบ่งตามกลุ่มของระดับพลังงาน (n) โดยจำนวนอิเล็กตรอนที่มากที่สุดในแต่ละระดับพลังงานมีค่าไม่เกิน 2n2
n = 1 จำนวน 2 อิเล็กตรอน
n = 2 จำนวน 8 อิเล็กตรอน
n = 3 จำนวน 18 อิเล็กตรอน
n = 4 จำนวน 32 อิเล็กตรอนจำนวนอิเล็กตรอนในระดับพลังงานนอกสุด (Valence Electron) จะมีได้มากที่สุดไม่เกิน8 อิเล็กตรอน
เลขอะตอม (Atomic Number : Z) คือ จำนวนโปรตอนในนิวเคลียสของแต่ละอะตอมของธาตุ ซึ่งปกติอะตอมที่เป็นกลางจะมีจำนวน ประจุบวกเท่ากับประจุลบเสมอ จึงทำให้จำนวนโปรตอนกับจำนวนอิเล็กตรอนของธาตุมีค่าเท่ากันเลข
อะตอม = จำนวนโปรตอน = จำนวนอิเล็กตรอน เลขมวล (Mass Number : A) คือ ผลรวมของจำนวนนิวตรอนกับจำนวนโปรตอนที่อยู่ในนิวเคลียสของอะตอม ยกเว้นอะตอมของไฮโดรเจน ซึ่งมีจำนวนโปรตอน 1 ตัว ไม่มีนิวตรอน
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน= เลขอะตอม + จำนวนนิวตรอน
สัญลักษณ์นิวเคลียส (Nuclear Symbol)

เมื่อ A แทน เลขมวล
Z แทน เลขอะตอม
X แทน สัญลักษณ์ของธาตุ
เลขอะตอม = จำนวนโปรตอน = จำนวนอิเล็กตรอน
11 = จำนวนโปรตอน = จำนวนอิเล็กตรอนเลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
23= 11 + จำนวนนิวตรอนจำนวนนิวตรอน = 23 - 11 = 12
นั่นคือ ธาตุโซเดียมมีจำนวนโปรตอน, อิเล็กตรอนและนิวตรอนเท่ากับ 11, 11, 12 ตามลำดับ
ตารางธาตุกับการจัดเรียงอิเล็กตรอน
ไอโซโทป คือ อะตอมของธาตุชนิดเดียวกันซึ่งมีจำนวนโปรตอนเท่ากันแต่มีจำนวนนิวตรอนไม่เท่ากัน ซึ่งการที่มีจำนวนนิวตรอนไม่เท่ากันนี้เอง ทำให้เลขมวลไม่เท่ากัน ตัวอย่างเช่น ไอโซโทปของธาตุคาร์บอนซึ่งอาจพบในรูปของคาร์บอน –12 และคาร์บอน –14
รูป ไอโซโทปของคาร์บอน
โมเลกุล (Molecule) คือ กลุ่มอะตอมอย่างน้อย 2 อะตอม ที่มารวมกันอยู่ด้วยแรงดึงดูดทางเคมี โดยโมเลกุลนั้นอาจประกอบด้วยอะตอมของธาตุชนิดเดียวกัน หรือ อะตอมของธาตุตั้งแต่สองชนิดขึ้นไปมารวมกันอยู่ด้วยอัตราส่วนที่แน่นอนตามกฎสัดส่วนคงที่ เช่น H2 , H2O
ไอออน (Ion) คือ อะตอมหรือกลุ่มอะตอมที่มีประจุ จากการที่อะตอมเป็นกลางทำให้จำนวนโปรตอน (ประจุบวก) และจำนวนอิเล็กตรอน (ประจุลบ) เท่ากัน ถ้าอะตอมที่เป็นกลางนั้นรับอิเล็กตรอนเพิ่มเข้ามาจะทำให้จำนวนอิเล็กตรอนมากกว่าจำนวนโปรตอนเกิดเป็นไอออนลบ (Negative Ion) ขึ้น ในทางตรงข้าม ถ้าอะตอมที่เป็นกลางนั้นสูญเสียอิเล็กตรอนจะทำให้จำนวนอิเล็กตรอนน้อยกว่าจำนวนโปรตอนเกิดเป็นไอออนบวก (Positive Ion)
ธาตุและสารประกอบ
ธาตุ (Element) คือ สารที่ไม่สามารถแยกออกเป็นสารอื่นได้ด้วยวิธีการทางเคมี ปัจจุบันมีธาตุทั้งหมด 118 ธาตุ เป็นธาตุที่เกิดในธรรมชาติ 83 ธาตุ และธาตุที่นักวิทยาศาสตร์ทำการสังเคราะห์ด้วยกระบวนการนิวเคลียร์ สัญลักษณ์ของธาตุจะใช้เฉพาะสำหรับธาตุหนึ่งๆ โดยตัวอักษรตัวแรกจะต้องเขียนด้วยตัวอักษรตัวใหญ่เสมอ และถ้ามีอักษรที่สองจะใช้ตัวเล็ก เช่น C Co เป็นต้น
ธาตุแบ่งออกเป็น 3 กลุ่มใหญ่ๆ คือ โลหะ อโลหะ และกึ่งโลหะ
สารประกอบ (Compound) คือ สารที่ประกอบด้วยอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกันทางเคมีในอัตราส่วนที่แน่นอน เช่น น้ำประกอบด้วย ไฮโดรเจน H 2 ส่วน และออกซิเจน O 1 ส่วน เขียนแทนเป็น H2O
ตารางพีริออดิก หรือ ตารางธาตุ ( Periodic Table )
ตารางธาตุ คือ ตารางที่รวบรวมธาตุต่าง ๆ เข้าเป็นหมวดหมู่ ตามคุณสมบัติที่เหมือน ๆ กัน ไว้เป็นพวกเดียวกัน เพื่อสะดวกในการจดจำและศึกษา
ตารางธาตุ เป็นตารางที่เรียงตามเลขอะตอมจากซ้ายไปขวา และให้ธาตุที่มีสมบัติคล้ายกันอยู่ในแนวดิ่งเดียวกัน ตารางธาตุ แบ่งธาตุเป็นแนวนอน 7 แถว เรียกว่า คาบ (Period) และแนวตั้ง 18 แถว เรียกว่า หมู่ (Group) แถวตั้งหรือหมู่แบ่งออกเป็นหมู่A เรียกว่า
ธาตุเรพรีเซนเตติฟ (Representative elements) โดยธาตุหมู่ A จะมีหมู่ 1A ถึงหมู่ 8A เมื่อ
หมู่ 1A เป็นธาตุที่มีความเป็นโลหะมากที่สุดเรียกว่า โลหะแอลคาไล (Alkali Metal)หมู่ 2A เรียกว่า โลหะแอลคา ไลน์เอิร์ท (Alkaline Earth Metal)หมู่ 7A มีความเป็นอโลหะมากที่สุดเรียกว่า แฮโลเจน (Halogen)หมู่ 8A เรียกว่า แก๊สเฉื่อย หรือแก๊สมีตระกูล (Noble Gas)และหมู่ B เรียกว่า ธาตุทรานซิชัน (Transition elements)
ตารางธาตุ
ตารางธาตุ คือ ตารางที่ใช้แสดงธาตุเคมี คิดค้นขึ้นโดยนักเคมีชาวรัสเซีย ดมีตรี เมนเดเลเยฟ ในปี พ.ศ. 2412จากการสังเกตว่าเมื่อนำธาตุต่างๆมาเรียงตัวลำดับเลขอะตอม คุณสมบัติต่าง ๆ ของธาตุที่นำมาเรียงนั้นจะมีลักษณะคล้ายกันเป็นช่วง ๆ ซึ่งในปัจจุบันตารางธาตุได้เป็นส่วนหนึ่งในการเรียนการสอนวิชาเคมีด้วย
ประวัติตารางธาตุ
เริ่มต้นจาก จอห์น นิวแลนด์ส ได้พยายามเรียงธาตุตามมวลอะตอม แต่เขากลับทำให้ธาตุที่มีสมบัติต่างกันมาอยู่ในหมู่เดียวกัน นักเคมีส่วนมากจึงไม่ยอมรับตารางธาตุของนิวแลนด์ส ต่อมา ดมีตรี เมนเดเลเยฟ จึงได้พัฒนาโดยพยายามเรียงให้ธาตุที่มีสมบัติเหมือนกันอยู่ในหมู่เดียวกัน และเว้นช่องว่างไว้สำหรับธาตุที่ยังไม่ค้นพบ พร้อมกันนั้นเขายังได้ทำนายสมบัติของธาตุใหม่ไว้ด้วย โดยใช้คำว่า เอคา (Eka) นำหน้าชื่อธาตุที่อยู่ด้านบนของธาตุที่ยังว่างอยู่นั้น เช่น เอคา-อะลูมิเนียม (ต่อมาคือธาตุแกลเลียม) เอคา-ซิลิคอน (ต่อมาคือธาตุเจอร์เมเนียม) แต่นักเคมีบางคนในยุคนั้นยังไม่แน่ใจ เนื่องจากว่าเขาได้สลับที่ธาตุบางธาตุโดยเอาธาตุที่มีมวลอะตอมมากกว่ามาไว้หน้าธาตุที่มีมวลอะตอมน้อยกว่า ดมีตรีได้อธิบายว่า เขาต้องการให้ธาตุที่มีสมบัติเดียวกันอยู่ในหมู่เดียวกัน เมื่อดมีตรีสามารถทำนายสมบัติของธาตุได้อย่างแม่นยำ และตารางธาตุของเขาไม่มีข้อน่าสงสัย ตารางธาตุของดมีตรีก็ได้รับความนิยมจากนักเคมีในสมัยนั้นเป็นต้นมา
ตารางธาตุแบบมาตราฐาน
 ศึกษาค้นคว้าเพิ่มเติม
ศึกษาค้นคว้าเพิ่มเติมhttp://http://www.thaigoodview.com/library/contest2551/science04/109/unt7/un7.html
http://www.il.mahidol.ac.th/course/ap_chemistry/atomic_structure/atomic_structure_home.htmhttp://web.ku.ac.th/schoolnet/f-snet5.htm
http://web.ku.ac.th/schoolnet/snet5/topic2/periodic1.html
http://www.prc.ac.th/chemistry/ http://www.manisila.com/index.php?page=showtopics&fn=view&id=10http://www.ptable.com/Images/ตารางธาตุ.pnghttp://th.wikipedia.org/wiki/ตารางธาตุ














 อโลหะเมื่อรับอิเล็กตรอนก็จะกลายเป็นไอออนลบ
อโลหะเมื่อรับอิเล็กตรอนก็จะกลายเป็นไอออนลบ  ประจุบวกและลบที่เกิดขึ้นก่อให้เกิดแรงดึงดูดทางไฟฟ้าซึ่งกันและกันเกิดเป็นพันธะไอออนิก และเพื่อความเข้าใจมากขึ้นขออธิบายการเกิดพันธะไอออนิกระหว่าง อะตอมของโซเดียม และ คลอไรด์พันธะอิออนิก เป็นพันธะที่แข็งแรง ซึ่งจะมีความแข็งแรง (Strong) แต่เปราะ (Brittle) จุดหลอมเหลวและจุดเดือดสูง ตัวอย่างเช่น การเกิดพันธะระหว่างโซเดียม (Na)กับคลอรีน (Cl) หรือออกไซด์ของโลหะทั้งหลาย11Na มีการจัดเป็น 1s2 2s2 2p6 3s117Cl มีการจัดเป็น 1s2 2s2 2p6 3s2 3p5โซเดียมจะให้อิเล็กตรอนแก่คลอรีนจำนวน 1 ตัวซึ่งทำให้โซเดียมเสถียรและมีปะจุบวกหนึ่งส่วนคลอรีนรับปะจุจากโซเดียมมา 1 ตัวทำให้คลอรีนเสถียรและมีปะจุลบหนึ่ง ดังนั้นจึงทำให้เกิดแรงดึงดูดทางไฟฟ้าระหว่างคลอรีนกับโซเดียม
ประจุบวกและลบที่เกิดขึ้นก่อให้เกิดแรงดึงดูดทางไฟฟ้าซึ่งกันและกันเกิดเป็นพันธะไอออนิก และเพื่อความเข้าใจมากขึ้นขออธิบายการเกิดพันธะไอออนิกระหว่าง อะตอมของโซเดียม และ คลอไรด์พันธะอิออนิก เป็นพันธะที่แข็งแรง ซึ่งจะมีความแข็งแรง (Strong) แต่เปราะ (Brittle) จุดหลอมเหลวและจุดเดือดสูง ตัวอย่างเช่น การเกิดพันธะระหว่างโซเดียม (Na)กับคลอรีน (Cl) หรือออกไซด์ของโลหะทั้งหลาย11Na มีการจัดเป็น 1s2 2s2 2p6 3s117Cl มีการจัดเป็น 1s2 2s2 2p6 3s2 3p5โซเดียมจะให้อิเล็กตรอนแก่คลอรีนจำนวน 1 ตัวซึ่งทำให้โซเดียมเสถียรและมีปะจุบวกหนึ่งส่วนคลอรีนรับปะจุจากโซเดียมมา 1 ตัวทำให้คลอรีนเสถียรและมีปะจุลบหนึ่ง ดังนั้นจึงทำให้เกิดแรงดึงดูดทางไฟฟ้าระหว่างคลอรีนกับโซเดียม
 ภาพแสดงแรงดึงดูดระหว่างโซเดียมอะตอมและคลอรีนอะตอมในผลึก
ภาพแสดงแรงดึงดูดระหว่างโซเดียมอะตอมและคลอรีนอะตอมในผลึก
 ภาพแสดงแรงดึงดูดของมุมระหว่างพันธะของพันธะโควาเลนต์แบบต่าง ๆ
ภาพแสดงแรงดึงดูดของมุมระหว่างพันธะของพันธะโควาเลนต์แบบต่าง ๆ

 โครงสร้างของน้ำที่เป็นของเหลว เกิดจากโมเลกุลของน้ำหลายๆโมเลกุลยึดกันด้วยพันธะไฮโดรเจน แต่ว่ายังไม่ค่อยเป็นระเบียบนักเนื่องจากโครงสร้างของน้ำมีส่วนหนึ่งดึงดูดกันอยู่ด้วยแรงขั้วคู่-ขั้วคู่ และ การสร้างและสลายพันธะไฮโดรเจนตลอดเวลา โครงสร้างของน้ำ (ของเหลว) แสดงได้ดังรูป
โครงสร้างของน้ำที่เป็นของเหลว เกิดจากโมเลกุลของน้ำหลายๆโมเลกุลยึดกันด้วยพันธะไฮโดรเจน แต่ว่ายังไม่ค่อยเป็นระเบียบนักเนื่องจากโครงสร้างของน้ำมีส่วนหนึ่งดึงดูดกันอยู่ด้วยแรงขั้วคู่-ขั้วคู่ และ การสร้างและสลายพันธะไฮโดรเจนตลอดเวลา โครงสร้างของน้ำ (ของเหลว) แสดงได้ดังรูป แรงยึดเหนี่ยวระหว่างโมเลกุลทั้ง 3 ชนิดนี้ พันธะไฮโดรเจนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงที่สุด ขณะที่แรงลอนดอนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงน้อยที่สุด และทั้ง 3 แรงนี้แข็งแรงน้อยกว่าพันธะโคเวเลนต์ พันธะไออนิก และพันธะโลหะมาก
แรงยึดเหนี่ยวระหว่างโมเลกุลทั้ง 3 ชนิดนี้ พันธะไฮโดรเจนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงที่สุด ขณะที่แรงลอนดอนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงน้อยที่สุด และทั้ง 3 แรงนี้แข็งแรงน้อยกว่าพันธะโคเวเลนต์ พันธะไออนิก และพันธะโลหะมาก 2. แรงดึงดูดระหว่างขั้ว (Dipole -pole forces)
2. แรงดึงดูดระหว่างขั้ว (Dipole -pole forces) 3. แรงดึงดูดระหว่างขั้วถาวรกับขั้วที่ถูกเหนี่ยวนำ(dipole - induced dipole forces)
3. แรงดึงดูดระหว่างขั้วถาวรกับขั้วที่ถูกเหนี่ยวนำ(dipole - induced dipole forces)


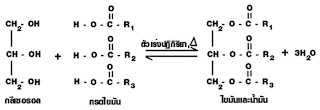
 การป้องกัน เติมสารกันเหม็นหืน (Antioxidiant) เช่น วิตามิน E วิตามิน C สาร BHTSaponification เป็นปฏิกิริยาไฮโดรลิซิสไขมันและน้ำมันด้วยเบส เป็นปฏิกิริยาที่เกิดจากไขมันและ น้ำมันกับด่าง เกิดเกลือของกรดไขมัน (สบู่) กับกลีเซอรอล ดังนี้
การป้องกัน เติมสารกันเหม็นหืน (Antioxidiant) เช่น วิตามิน E วิตามิน C สาร BHTSaponification เป็นปฏิกิริยาไฮโดรลิซิสไขมันและน้ำมันด้วยเบส เป็นปฏิกิริยาที่เกิดจากไขมันและ น้ำมันกับด่าง เกิดเกลือของกรดไขมัน (สบู่) กับกลีเซอรอล ดังนี้  การตรวจหาปริมาณกรดไขมันไม่อิ่มตัวในไขมันและน้ำมัน ไขมันและน้ำมันที่ประกอบด้วยกรดไขมันไม่อิ่มตัว (C = C) ทำปฏิกิริยากับสารละลาย Br2 หรือ I2ได้เกิดปฏิกิริยาการเติมตรงบริเวณC กับ C ที่จับกันด้วยพันธะคู่ของกรดไขมันไม่อิ่มตัวในไขมันและน้ำมันนั้น
การตรวจหาปริมาณกรดไขมันไม่อิ่มตัวในไขมันและน้ำมัน ไขมันและน้ำมันที่ประกอบด้วยกรดไขมันไม่อิ่มตัว (C = C) ทำปฏิกิริยากับสารละลาย Br2 หรือ I2ได้เกิดปฏิกิริยาการเติมตรงบริเวณC กับ C ที่จับกันด้วยพันธะคู่ของกรดไขมันไม่อิ่มตัวในไขมันและน้ำมันนั้น





